利用流式细胞术(intracellular cytometry)对细胞内靶点进行分析提出了许多技术挑战,这些挑战在测量细胞表面表位或测量活细胞中染料摄取/处理(例如钙黄绿素AM)时通常不会遇到。一般来说,细胞(悬浮液)必须首先“固定”以保存和维持目标表位的结构和位置,然后“通透”以允许探针(例如抗体)理想地进入所有细胞室(细胞质、线粒体、核糖体、细胞核等)。
一般来说,细胞固定是通过使用交联固定剂(如甲醛、戊二醛)或低分子量醇(甲醇、乙醇)来完成的,它们通常起到“凝固”蛋白质的作用。甲醛的优点是一般保持天然蛋白质的整体构象。然而,由于甲醛在肽、多糖和脂类上产生多个反应位点,因此交联可以隐藏或隔离表位,使得它们在固定后不能自由地被抗体探针获得。在翻译后蛋白质修饰(如磷酸化、甲基化、乙酰化、泛素化等)的研究中,甲醛固定的另一个好处是,甲醛似乎既能“固定”目标氨基酸(丝氨酸、苏氨酸、酪氨酸)的修饰,并且还抑制活细胞中这些靶点的降解(例如,磷酸化的磷酸酶去除,甲基化的去甲基化酶去除,等等)。相比之下,酒精固定通常会导致一些(磷酸化和潜在的其他蛋白质)修饰的检测较差。
全血样本的固定
免疫学领域的研究经常利用外周血、淋巴结或骨髓细胞,通常通过初步纯化步骤(Ficoll–Hypaque、低渗溶解、氯化铵)去除红细胞。此外,初步纯化技术可以去除潜在的靶细胞群(例如,使用Ficoll–Hypaque的细胞损失)。本节首先介绍含红细胞样本的固定和渗透技术,然后介绍分离细胞群(组织培养细胞、分离淋巴细胞、单核细胞等)的固定和渗透技术。
固定后,进行细胞通透,以获得进入细胞内部。渗透用试剂包括有洗涤剂(例如Triton X-100,NP-40)或皂化剂(例如皂甙)或低分子量醇(甲醇或乙醇)。本文介绍一种用于临床样本(全血、骨髓)的固定和渗透技术。将固定剂甲醛直接添加到临床样本中(立即“固定”磷酸化表位,并防止信号抑制剂从细胞中分离出来,从而导致其抑制作用的快速逆转)。再以适当的浓度和时间将Triton X-100直接添加到样品(仍含有甲醛)中,可实现红细胞溶解和白细胞固定,而不会造成白细胞数量的显著损失。注,严格遵守孵育时间是很重要的。
如图14所示,使用甲醛/Triton X-100技术固定渗透的健康人全血各群分布。单核细胞群(蓝色)的位置是用CD14确定的。然而,单用散射光信号从细胞碎片中分离淋巴细胞是有问题的,红细胞裂解产生大量碎片与淋巴细胞重叠。结合CD45/CD14可将淋巴、单核、粒细胞清晰区分。显示的数据是在红细胞裂解步骤后的一次洗涤结果,增加额外的洗涤步骤可显著减少碎片数量。
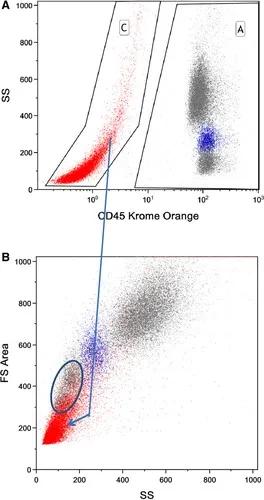
图14. 甲醛固定人全血,TX-100通透。用CD14-PE-Cy7和CD45-KromeOrange鉴定白细胞群。碎片(红色)通过CD45与SS(上图C)进行识别。使用CD14 PE-Cy7(未显示)完成外周血单核细胞的鉴定(图中蓝色)。
全血染色材料
全血固定通透过程
甲醇对表位染色的影响
一些细胞内或核内的表位在使用上述甲醛-Triton固定、通透后仍然很难被抗体探针获得。这可能是所有类似的醛-洗涤剂(仅)固定和渗透技术的局限性,如磷酸化STAT蛋白就不能被检测到。用冷(4°C)甲醇处理固定和渗透细胞5-10min后即可检测到这些表位,但须小心验证甲醇处理的效果,特别是荧光抗体染色后处理和使用下文所述的串联染料时。如图15所示,用高达50%的冷甲醇处理固定和渗透的全血(使用GM-CSF激活)后,P-STAT5染色结果和未处理样品信号强度相似。而,用80%冷甲醇处理会产生明显更强的P-STAT5信号。图15还显示了50%(上)和80%(下)浓度的甲醇处理对P-ERK和P-S6染色(核糖体S6蛋白)的影响:P-ERK信号强度的变化最小,P-S6信号降低约20%。因此,需测试确定不同浓度甲醇处理对不同靶表位的影响。
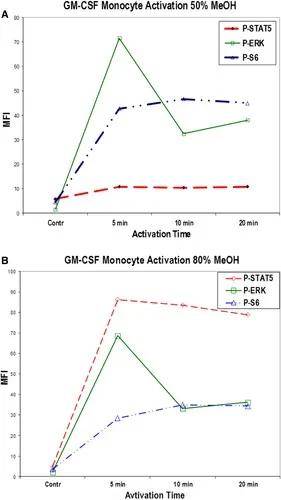
图15. 不同浓度甲醇处理,对GM-CSF体外激活不同时长的外周血单个核细胞上磷酸化分子检测的影响。正常供体的全血在37°C下用GM-CSF在体外处理20min。一部分固定和通透样品在4°C下用50%甲醇处理(A),另一部分用80%甲醇处理(B)。洗涤后,所有样品用(_⋄_)P-STAT5、(_□_)P-ERK和(_Δ_)P-S6染色。
虽然甲醇进一步处理对某些磷酸化表位的评估很重要,但它也具有降低(或消除)用于检测特定细胞群的其他重要表位的信号。根据作者经验,对人血液或骨髓中的某些髓系-单核细胞标记物(CD14、CD33、CD64)影响较大,而对干细胞或祖细胞标记物(CD34、CD117)影响较小。
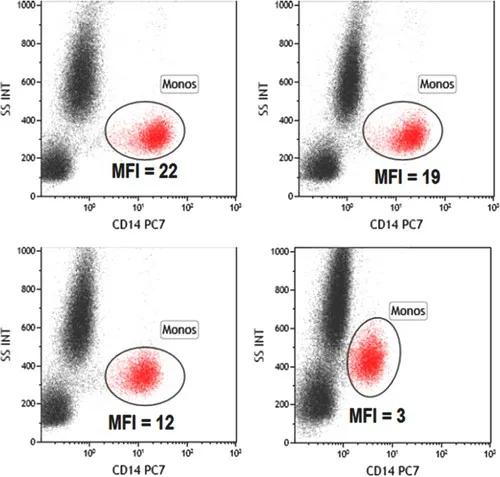
图16. 甲醇处理对人外周血单核细胞CD14染色的影响。在固定和渗透之前(左)或之后(右)染色CD14 PE-Cy7。样品用50%(上)或80%(下)甲醇处理。左上-左下比较显示了不同浓度甲醇处理对染料的影响,左右比较显示了甲醇处理对抗原表位的影响。
非贴壁组织培养细胞的固定和通透
组织培养细胞(锚定非依赖性细胞系)的常规固定和通透是通过甲醛固定,无水甲醇对细胞质和核膜进行通透。通常需同时对细胞表面和细胞质或核内表位进行染色,一般会先染表面再固定通透染胞内,尤其是单独使用酒精固定处理而改变(如CD19)或破坏(如CD14、CD15、CD64)的细胞表面标记。
甲醛固定剂最佳浓度的测定
磷酸化表位的最佳检测似乎受到用于固定不同类型细胞的甲醛浓度的影响。如图17所示,在用0.05到0.4%的甲醛(37°C,10min)处理后,K562细胞中的P-STAT5最佳检测。由于潜在表位交联/固定的程度与甲醛浓度、孵育时间和温度成正比,所有这三个变量每次都应进行相同的控制和执行。如图17所示,在较高的最终甲醛浓度下,P‐STAT5信号降低,可能是由于过度固定和抗体结合物限制了磷酸表位的可及性。如图17所示,单独用无水甲醇处理(无甲醛:第一数据点)产生背景水平的信号。
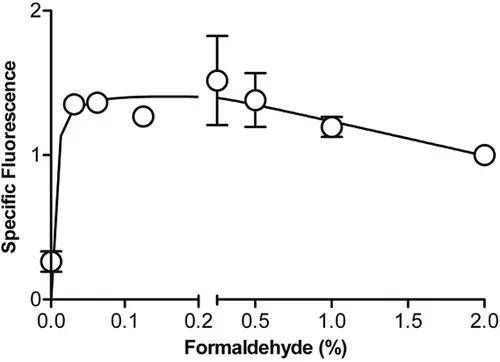
图17. 甲醛浓度对K562细胞中P-STAT5染色结果的影响。不同浓度甲醛固定细胞,37°C,10min,渗透并用抗P-STAT5PE染色。
非贴壁培养细胞的常规固定、通透和抗体染色
对于非贴壁组织培养细胞的固定和通透,我们在组织培养基(通常含有15-20%的FBS)中直接向亚融合细胞(理想情况下在收获前12-24小时重新喂食)中添加最佳浓度的甲醛,将细胞放回37°C的组织培养箱中培养10分钟,然后离心(400×g,10分钟),并使用涡流混合器进行再悬浮(注:此时细胞聚集,需要用涡流进行剧烈处理,以实现所有细胞的再悬浮)。涡流时,添加无水甲醇(储存在-20°C下),添加∼1 mL无水甲醇每107个细胞。在这一点上,细胞可以在-20°C的密封容器中储存数周,而磷酸化表位(目前测试的表位)的检测没有明显减少。
对于细胞内表位的染色,将3–5×106个细胞放入每根试管(我们常规在1.2 mL微管中对组织培养细胞进行染色)。离心管(对于冷冻微量离心机,使用10 000rpm持续12 s),小心地吸取上清液,并将细胞团重新悬浮在1mL冷(4°C)洗涤液(Dulbecco的PBS/5%FCS或Dulbecco的PBS/5%无蛋白酶BSA)中,同时涡旋。将试管放在冰上5分钟,以使缓冲液平衡并除去残余酒精。如上所述离心。重复上述步骤,用冷洗涤液清洗两次。
在最后一个离心步骤后小心地去除上清液,并将细胞重悬在100µL抗体预混物中。重要的是,每种抗体都要滴定,以确保最佳的信噪比。冰(4°C)上避光孵育30分钟。
将细胞重新悬浮在0.5 mL冷洗涤液中进行流式细胞术分析(如果细胞要在1-2hr内进行分析)。更长时间后再进行分析,则将洗涤后的细胞离心,并将细胞团重悬在冷PBS/0.1%多聚甲醛中。在0.1%多聚甲醛中固定并在4°C避光下储存的细胞至少稳定24hr(光散射和磷酸表位检测)。应注意的是,一些磷酸表位的信号强度在冷洗涤液(如P-S6)中最终再悬浮的几分钟内开始显著降低。对于这些表位,强烈建议立即将细胞置于PBS/0.1%甲醛中,这可显著降低信号丢失率。